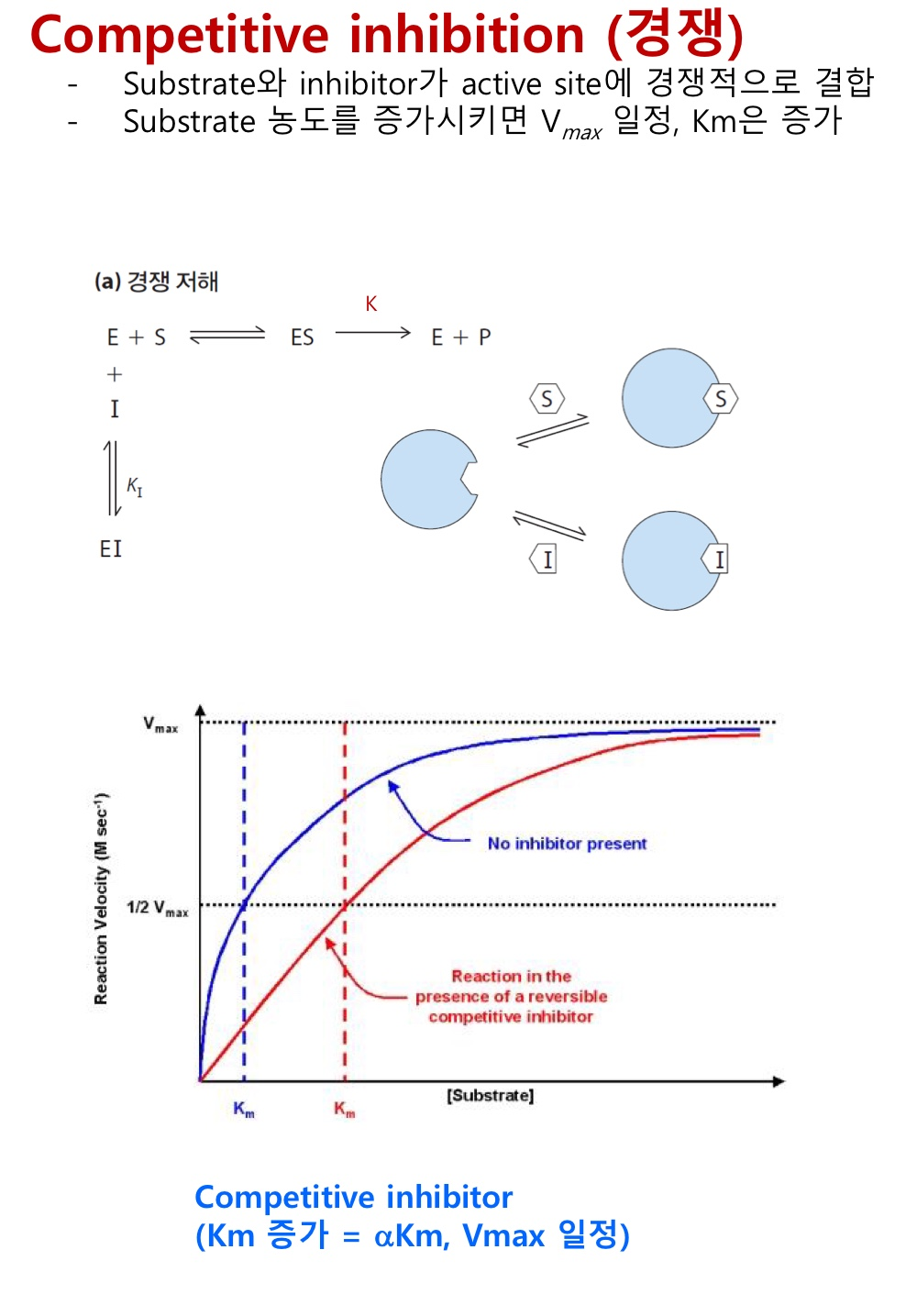
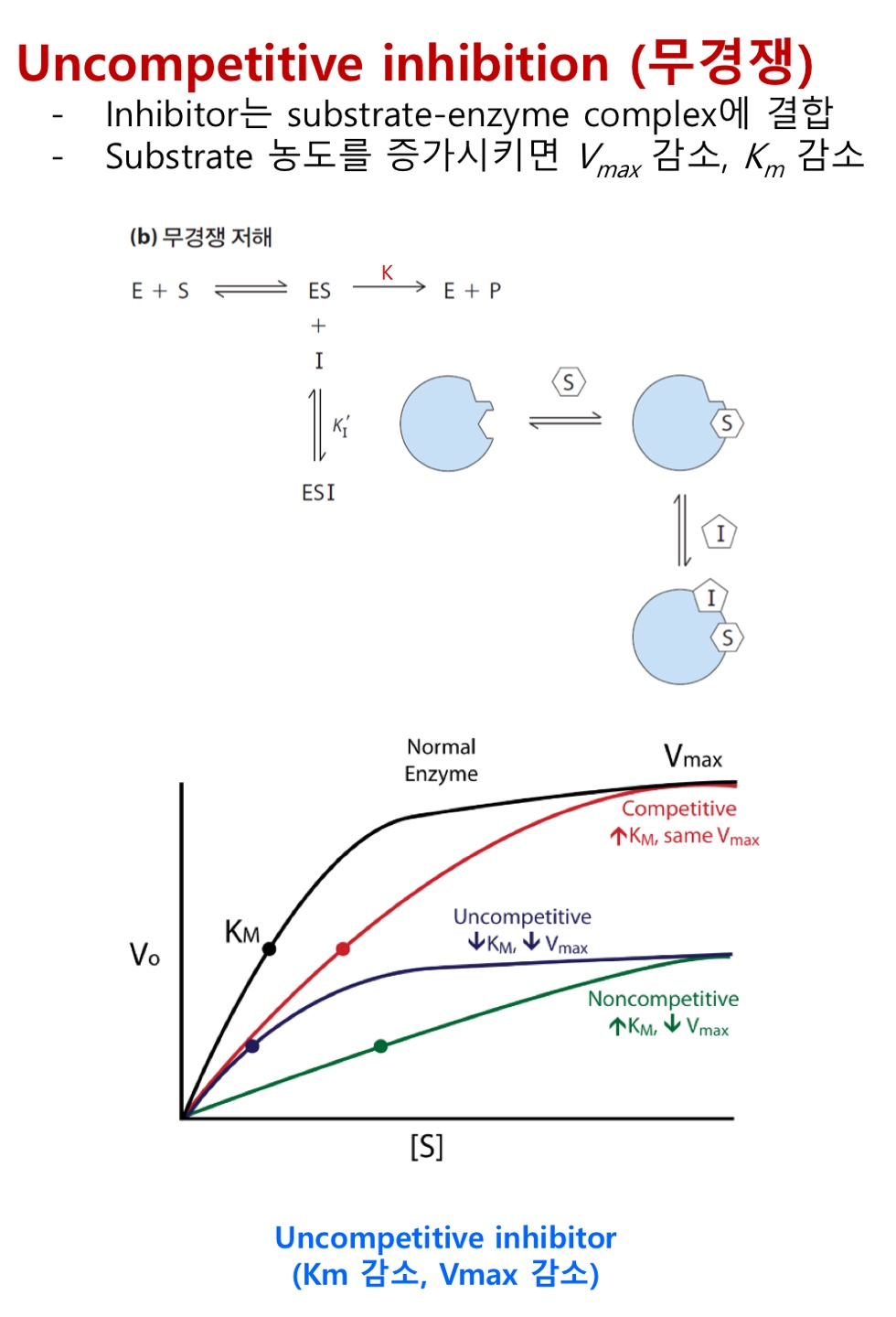
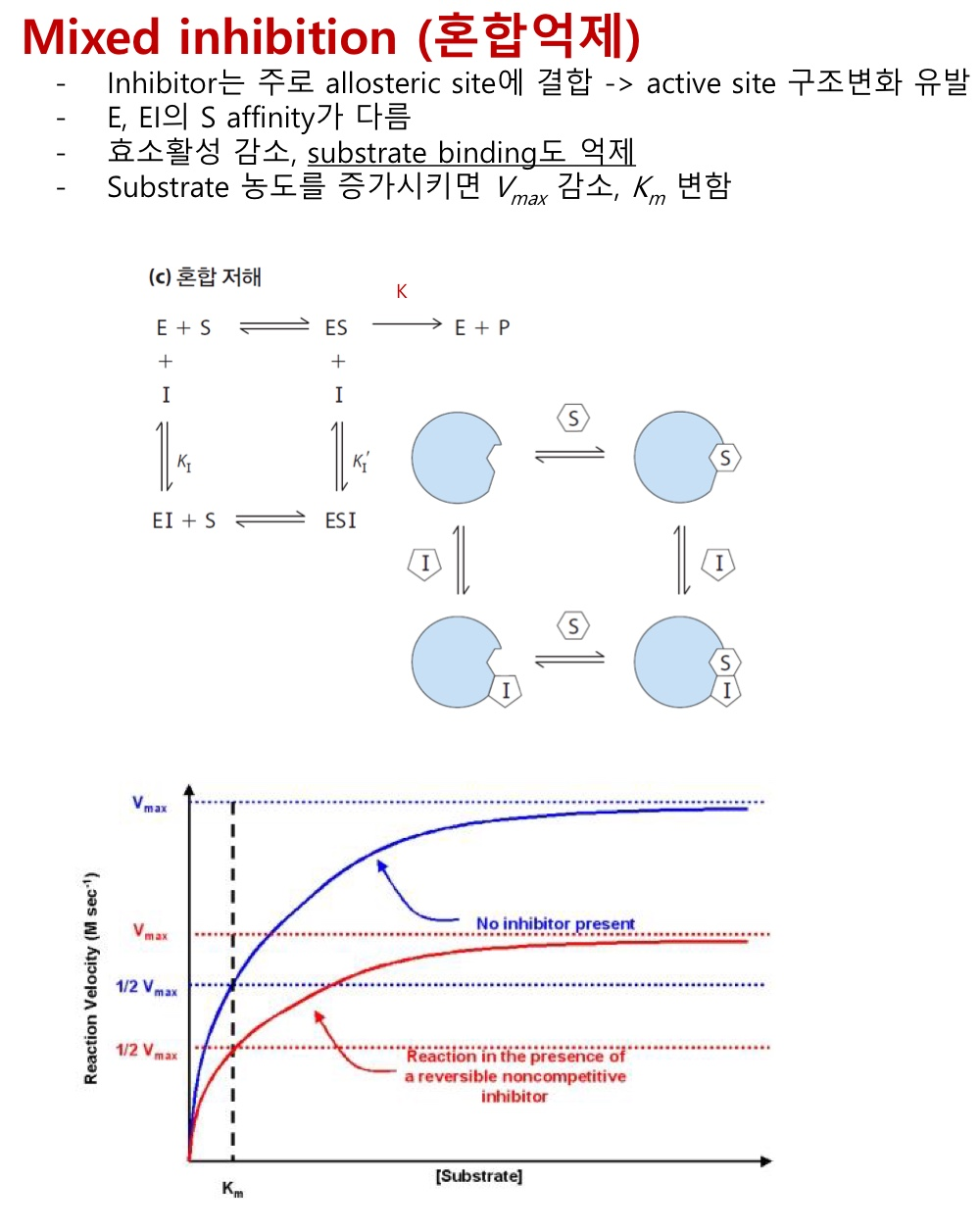
SECTION 1. 단백질과 효소의 구조와 기능
구조가 기능을 결정한다. Structure determines function

ch.3~5
ch.3 Amino Acid & Peptides
 a.a 의 구조
a.a 의 구조
 단백질을 이루는 20가지 a.a 분류 table
단백질을 이루는 20가지 a.a 분류 table
Hydrophilic:
Arginine, Asparagine, Aspartic acid, Cysteine, Glutamic acid, Glutamine, Glycine, Histidine, Lysine, Serine, Threonine
Hydrophobic:
Alanine, Isoleucine, Leucine, Methionine, Phenylalanine, Proline, Tryptophan, Tyrosine, Valine

Isoelectric pH(pI) = Net charge가 0이 되는 pka 2개의 평균

● R groups의 특징
glycine - 가장 작은 아미노산, 단백질의 꺾이는 부분에 多
hydrophobic R 그룹의 경우 세포질에 있는 단백질에 多
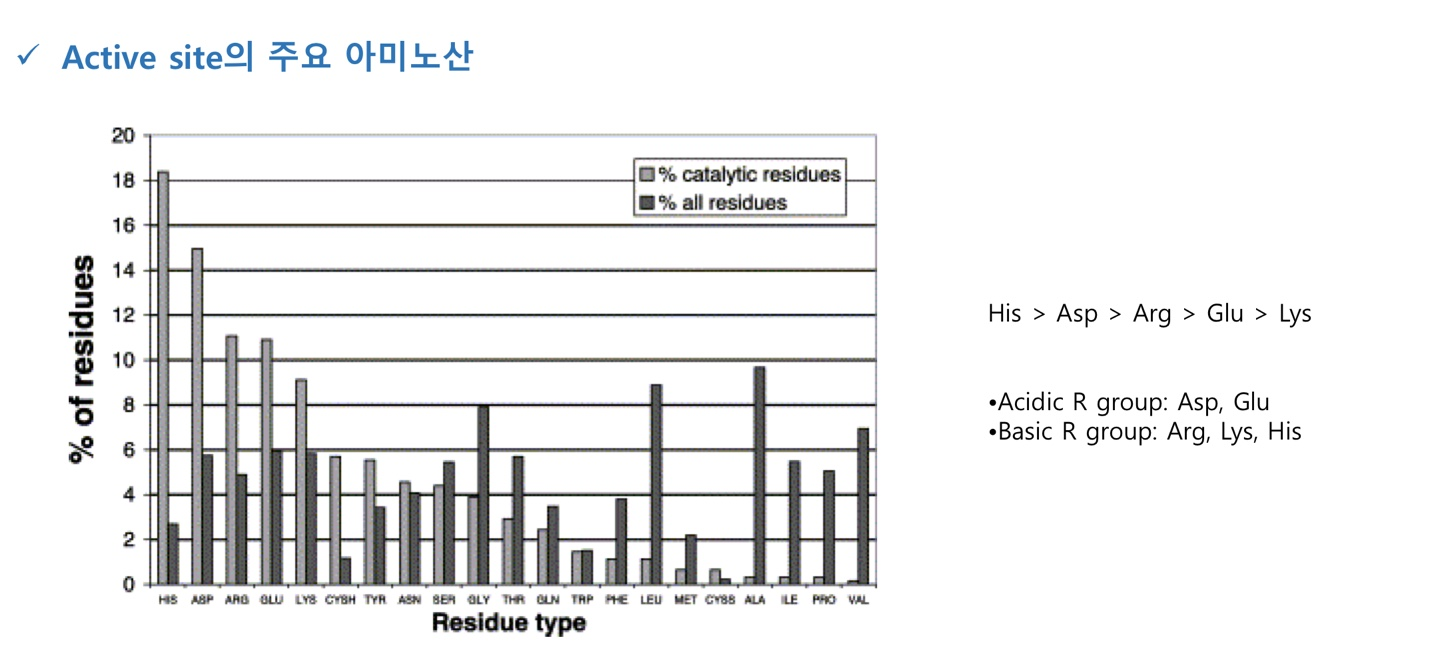
charged R 그룹은 enzyme의 site에 多
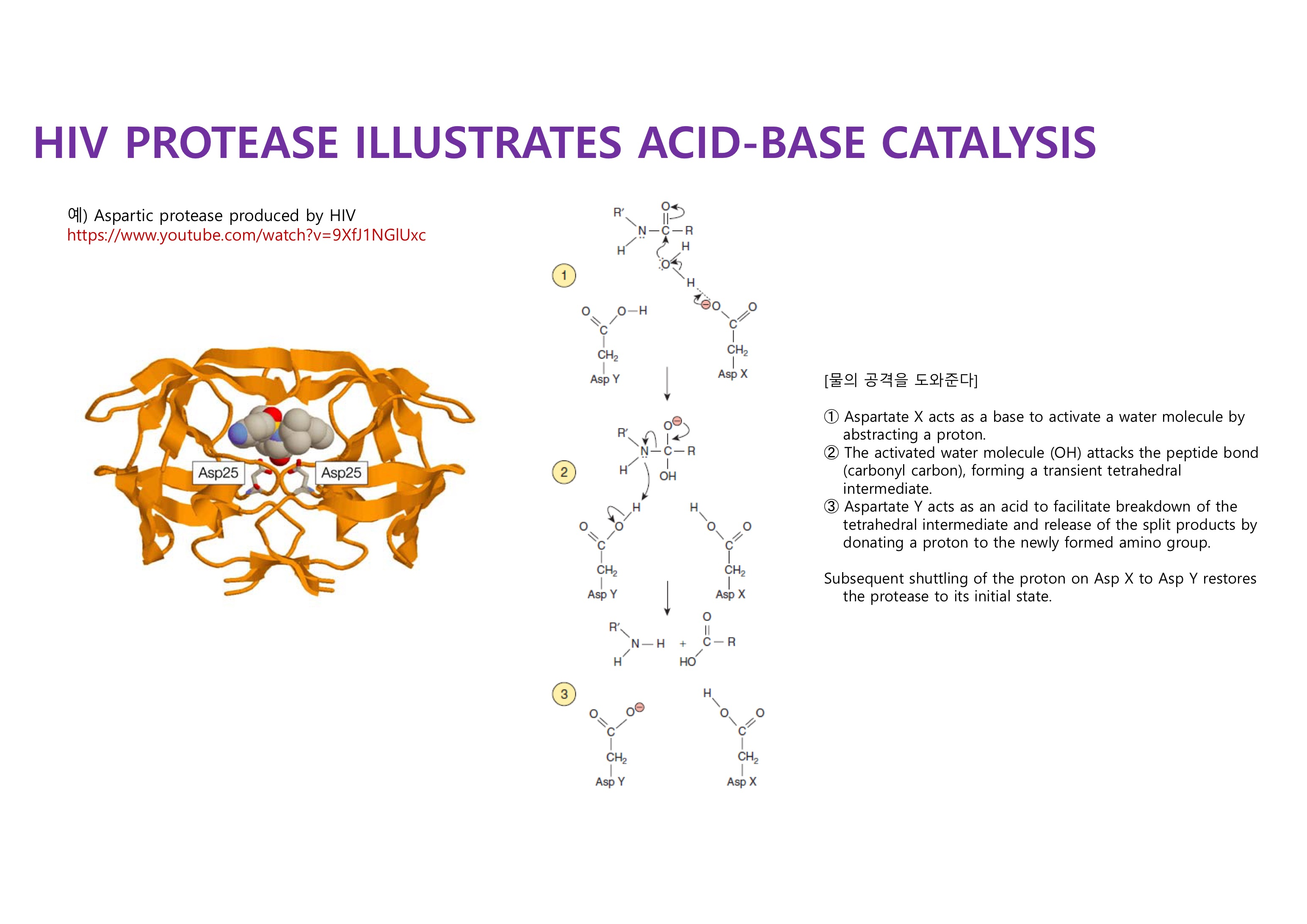
Histidine의 pKa는 체내 pH와 유사해서 base, acid로 모두 사용
R에 -OH가 있는 그룹은 인산화를 통한 enzyme activity를 조절
방향족 R은 280nm 파장 흡수(특히 Tryptophan)
ch.4 1차 구조의 결정
각종 크로마토그래피
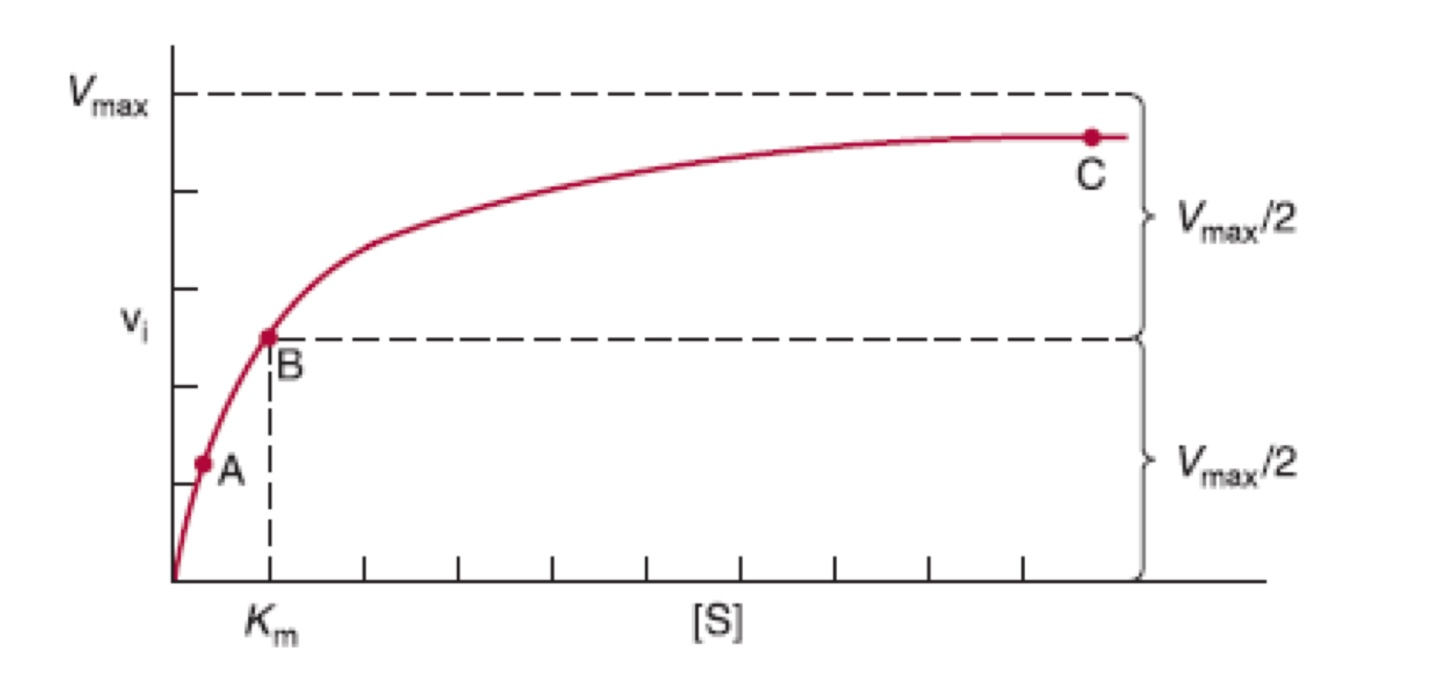
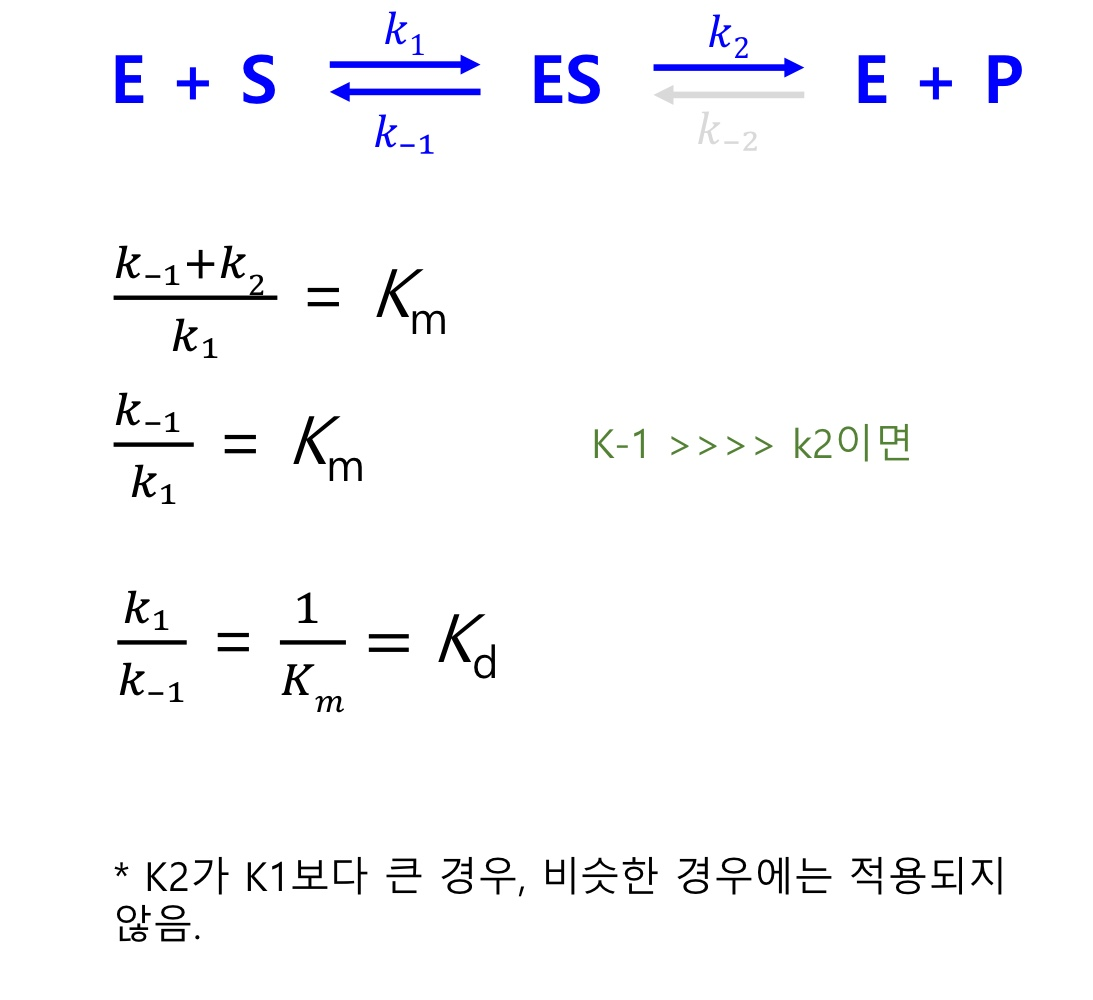
ch.5 높은 구조적 체계
단백질의
1차 구조 - a.a 서열
2차 구조 - α-helix , β-sheet, β-loops, β-turn (β-turn부분에는 Proline, Glycine 多)
3차 구조 - single protein의 3차원 구조 (ex. 미오글로빈)
4차 구조 - several protein의 복합체 (ex. 헤모글로빈)
Domain: 단백질의 기능적 단위
☆Protein Folding
단백질 서열 자체로 열역학적 안정성으로 인해 자연적인 folding 진행.
번역과 동시에 접힘 (in vivo co-translational)
Hsp(=chaperone) : protein folding in cells takes place in a more orderly and guided fashion.
단백질 입체구조 변형으로 발생하는 질병
Prions - mad cow disease, Creutzfeldt-Jakob disease
Aβ - Alzheimer's disease
Collagen - Scurvy (Vit.C 결핍)
Menkes syndrome (Copper 결핍)

콜라겐의 강도
1. Pro & Lys 의 hydrocylation (+Vit.C) → hydrocyproline, hydroxylysine → hydrogen bond 형성
2. Hydroxylysine에 일어나는 glycosylation
3. Crosslinks 형성 by Lysyl oxidase